Szegény ember vízzel főz...
és a gazdag is ...
2017. március 22 - Víz Világnapja
A közmondás szerint a szegény ember vízzel főz. Igazából ezt a közmondásunkat nem nagyon értem/értettem soha, ugyanis aki gazdag, az is vízzel főz. Az igaz, hogy sokan vannak, akik ásványvízzel főznek, de az is víz. De miért főzhetünk például benne? Miért nem fagynak be a tavak mélyei télen? Miért tartalmaz az emberi szervezet olyan nagy százalékban vizet? Miért oldódik olyan sokféle anyag a vízben? Miért ... Ugye az előző bejegyzésben említettem a miértek fontosságát a jelenségek vizsgálatában. Nem biztos, hogy minden bennetek is felmerült kérdésre a mai napon megkapjátok a választ, de egy-két dolgot megpróbálunk megvilágítani. Először is azt szeretném megvilágítani, hogy egy nagyon jó magyar tanárom elmagyarázta ám nekem a "szegény ember vízzel főz" közmondásunkat, mégpedig úgy, hogy a kezembe nyomta Móra Ferenc: Szegény ember vízzel főz című kis történetét, azzal hogy ebből biztos megértem. Akkoriban még nem volt ám internet, ahol magamtól utánanézhettem volna, hiszen én, ahogy azt már olvashattátok egy régebbi bejegyzésemben, idősebb vagyok, mint az internet! Mindenki nézzen utána, hogy mikor és hol született a mai internet őse!
Mit kell tudnunk tehát a vízről, a legfontosabb tulajdonságairól?
A víz egy olyan anyag, ami a Föld nevű, számomra nagyon fontos bolygón, a természetben mindhárom halmazállapotában előfordul. Vagyis mindenki láthat különösebb megerőltetés nélkül gáz, folyékony és szilárd halmazállapotú vizet, amiket ebben a sorrendben gőz, víz és jég hétköznapi néven nevezünk.
Kémiai és fizikai tulajdonságairól a következőket mondhatjuk el:
A víz, vagyis a dihidrogén-monoxid, amiből az okosok leszűrhetik a kémiai szerkezetét, vagyis, hogy di=kettő hidrogén atomot és mono=egy darab oxigén atomot tartalmaz. A kémiai képlete ennek megfelelően H2O.
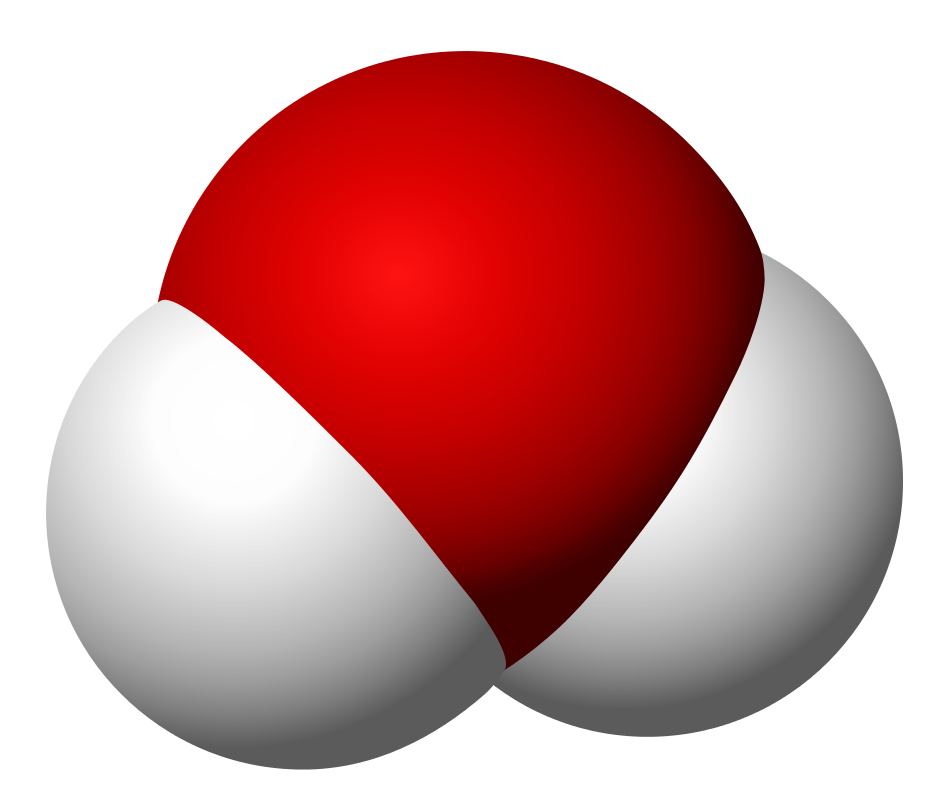
a víz 3D-s szerkezete
forrás:https://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Water_molecule_3D.svg/944px-Water_molecule_3D.svg.png [2017.március 22]
Egy előző bejegyzésemben már megemlítettem, miszerint a víz poláris molekula, vagyis az elektroneloszlás nem szimmetrikus, az oxigénhez kapcsolódó két hidrogénatom elektronegativitás vektora nem "oltja" ki egymást. Ahogy azt a már legkisebbek is fújják, a víz színtelen, szagtalan, íztelen kémiai anyag. Tegyük hozzá a nagyobbak kedvéért, hogy ne érje kritika a házunk táját, hogy ez közönséges körülmények között (=szobahőmérsékleten és légköri nyomáson) igaz.
A sűrűsége azonban már egy olyan tulajdonsága, ami hőmérséklettől függ, és az értéke kb. 1 g/cm3 .
A víz szolgál a Celsius hőmérsékleti skála 0 és 100-as pontjának alapjául. Vagyis Celsius úr úgy hozta létre a skáláját, hogy a víz olvadási hőmérséklete és a forráspontja közötti intervallumot 100 részre osztotta. Ezek szerint akkor a víz 0°C-on olvad és 100°C-on forr fel. (=olvadáspont és forráspont). Léteznek még más hőmérsékleti skálák is, mint például a Kelvin, vagy abszolút hőmérsékleti skála (azért hívjuk abszolút skálának, mert az abszolút nulla pont a kezdőpontja). A két skála összevetése látható az alábbi ábrán:
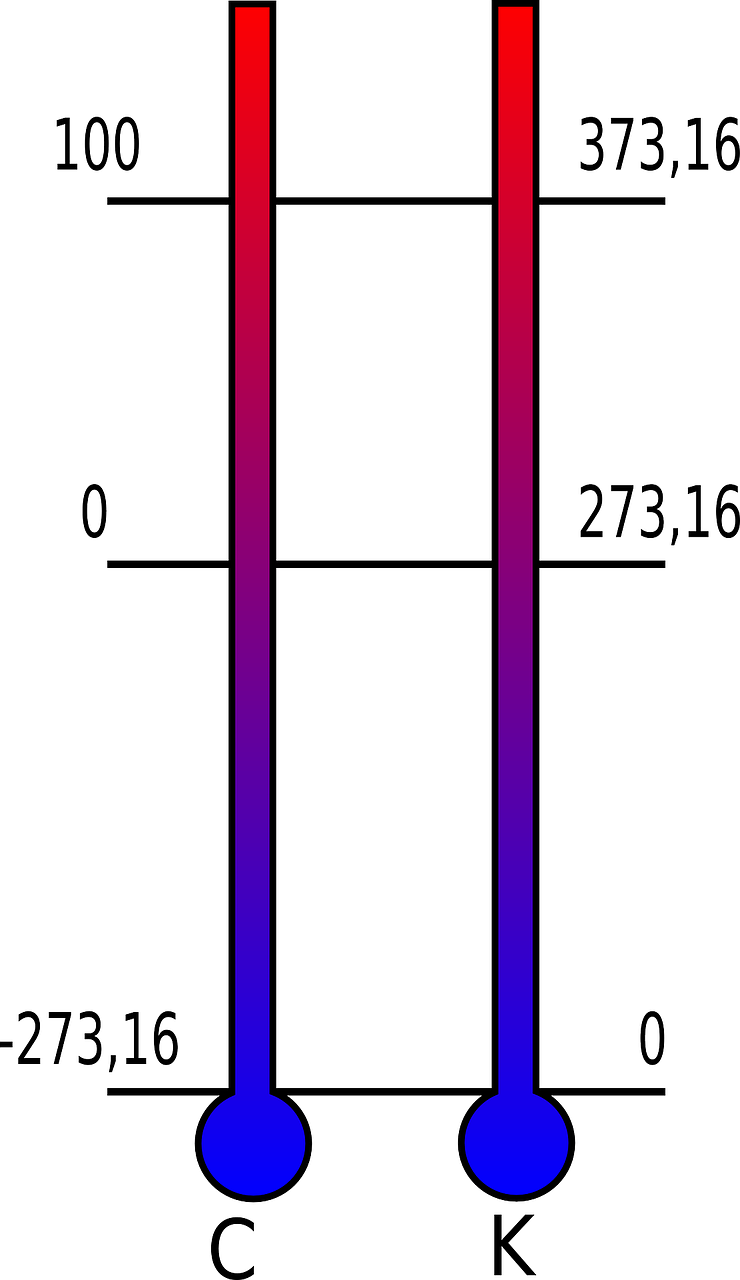
forrás: pixabay.com
Van egy nagyon érdekes jelenség, miszerint az oxigénnel szomszédos elemek (C, N, F, Si, P, S, Cl, stb ) és a hidrogén vegyületei 25°C-on és légköri nyomáson, a vízzel ellentétben mind gáz halmazállapotúak. Vagyis kijelenthetjük, hogy a víz olvadás- és forráspontja - moláris tömegéhez viszonyítva - szokatlanul magas, ezért közönséges körülmények között folyékony halmazállapotú. Ez az egyik olyan tulajdonsága, ami az emberiség számára olyan fontossá teszik a vizet! Ezt a szokatlan jelenséget az intermolekuláris (=molekulák közötti) hidrogénkötésnek köszönhetjük. A másodlagos hidrogénkötések, vagyis az intermolekuláris kölcsönhatás energiája az elsődleges kémiai kötésekhez képest elég kicsi. Ugyanakkor ezek az erők összeadódnak (=additívak), vagyis ha több ilyen kölcsönhatás van jelen egy időben (pld. a víz esetében), és akkor ez már elég jelentős mértékű lehet a molekulák között. Ennek a jelentős mértékű másodlagos kötési energiának a jelenléte megváltoztathatja az adott anyag fizikai jellemzőit, mint például az olvadáspont, forráspont, stb.
Ha megnézzük az ammóniát például, ami a nitrogén és a hidrogén vegyülete, képlete pedig NH3, akkor megtudhatjuk, hogy olvadáspontja -77,73 °C, míg a forráspontja -33,34 °C. Vagyis 25 fokon, normál nyomáson gáz halmazállapotú. Az ammónia 3D-s szerkezeti képe:
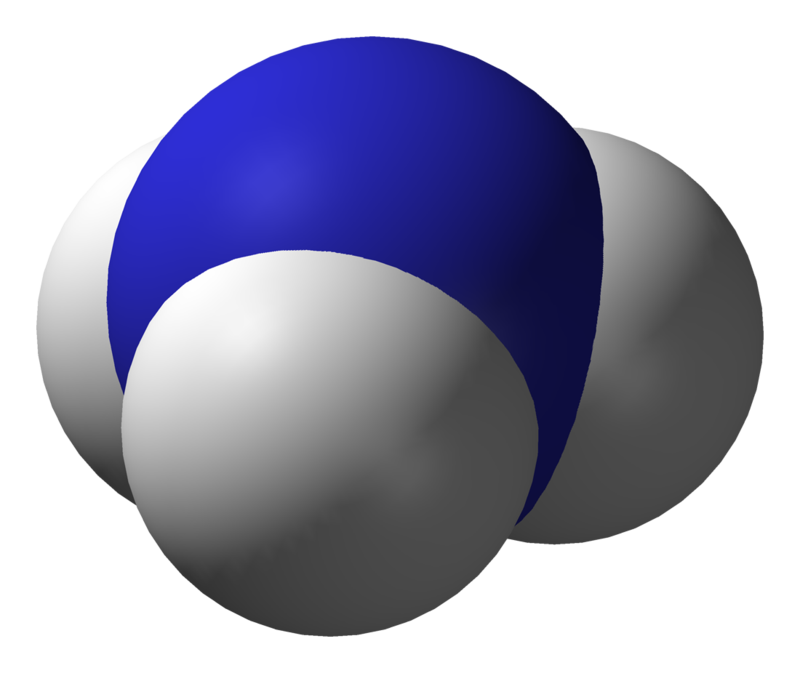
az ammónia 3D-s szerkezete
készítője, forrás:https://commons.wikimedia.org/wiki/User:Benjah-bmm27 [2017. március 22]
A víz másik nagyon fontos, életbevágó tulajdonsága az, hogy a jég sűrűsége kisebb, mint a vízé. Miért is olyan fontos, életbevágó tulajdonság ez? Nézzük meg, mi lenne ellenkező esetben:tételezzük fel, hogy a jég sűrűsége nagyobb lenne, mint a vízé. Akkor a jég, miután a víz felszínén kialakul, lesüllyedne a tárolóedény, vagy a természetes vizeknél a meder aljára. Vagyis a tavak úgymond alulról fagynának be, lehetetlenné téve az állat és növényvilág túlélését. Ebben az esetben valószínűleg többször is kihalt volna az ökoszisztéma, a fejlettebb élet a Földön.
Végezzünk el nagyon könnyű kísérletet:
Vegyünk egy pohár vizet. Ebbe a pohár vízbe tegyünk bele egy jégkockát. Kezdjük el vizsgálni a rendszerünket (rendszer=pohár víz + jégkocka)
A vizsgálat menete:
1-vizuálisan - vagyis ránézésre: megállapítjuk, miszerint a jég úszik, lebeg a vízen.
2-műszeresen - alkalmazott műszer: hőmérő. Megmérjük a pohárban lévő víz hőmérsékletét, rétegenként.
Megállapítjuk, hogy a felszín közelében 0 Celsius-fok körüli a hőmérséklete, míg az alján 4 fok körülit. Ez azért van, mert a víz sűrűbb 4 fokon, mint bármely más hőmérsékleten, így a 4 fokos réteg mindig a vízréteg alján lesz.Kijelenthetjük, hogy mivel a jég sűrűsége kisebb, mint a vízé, akkor a jég olvadása térfogatcsökkenéssel jár. A víz sűrűsége a hőmérséklet emelésével - más anyagokétól eltérően - 0 °C és 4 °C között nő!
Nézzük meg, hogy hogyan fagy meg egy vízcsepp kívülről befelé. A videót egy kutatócsoport töltötte fel. Nekem nagyon érdekes volt ez a felvétel, és bár tudtam, hogy a fagyasztott ételeknél, húsoknál a rostok között található víz, folyadék a fagyás folyamatában megsérti, roncsolja a rostokat, most vizuálisan is megfigyelhettem a folyamatot, azt amikor a vízcsepp szétrobban. A tudományos értekezés maga a http://journals.aps.org/prl/abstract/10.1103/PhysRevLett.118.084101 címen található.
forrás: https://www.youtube.com/watch?v=cS3FNd_TJv0&feature=youtu.be [2017.03.23]
Vagyis, ha emlékeztek még Ron Weasley hogy hozta fel a kardot a tó mélyéről, hát ez azért volt lehetséges, mert felülről fagynak be a tavak, és a halak + a varázskardok a 4 fokos vízben, a tó mélyén találhatók meg. Egyesek felvethetik a kérdést, hogy akkor a kis kerti tavak miért veszélyeztetettek a nagy hidegekben? A hangsúly a kis szócskán van, vagyis a tavacskák mélységén. Ugyanis van olyan hideg, amikor ezek a kis mélységű és kisméretű tavak teljesen a tó aljáig befagyhatnak. Azért ez nem következik be olyan egyszerűen, mert a keletkező vastag jégréteg a szerkezetének köszönhetően hőszigetelőként is működik a hideg levegő és a jégréteg alatti vízréteg között.
Március 22-én volt a Víz Világnapja, amikor emlékeztetjük a diákjainkat arra, miszerint az a luxus, hogy itt a csapból is víz folyik, nem mindenkinek adatik meg. Sajnos az iható, egészséges édesvíz mennyisége a Földön véges, erre figyelmeztet minket ez a kis UN-Water által készített rajzfilmecske is.
forrás: https://www.youtube.com/watch?v=UrJhsH0Sz_o [2017.március 23]
Üdvözlettel,
ScienceGuruk